最近,《自然》杂志对“明年可能影响科学”的七项技术进行了回顾。这七项技术分别是完整基因组、蛋白质结构分析、量子模拟、精确基因组调控、靶向基因治疗、空间多组学和基于CRISPR的诊断。
完整基因组
在2021年5月发表的预印本论文中,端粒到端粒协作报告了人类基因组的第一个端粒到端粒序列,在广泛使用的人类参考基因组序列GRCh38的基础上添加了近2亿个碱基对,并在最终结果中章节已完成。这就是人类基因组计划的内容。
GRCh38于2013年首次发布,是一种宝贵的研究工具和测序序列作图支架。然而,它还不够长,无法明确绘制高度重复的基因组序列。
长读长测序技术已被证明能够改变规则。这项技术由美国太平洋生物科学公司和英国牛津纳米孔技术公司开发,可以在一次读取中对数万或数十万个碱基进行测序。2020年,当T2TCollaboration首次重新组装孤立的这些微妙的“指纹”使得染色体的长而重复的部分更容易处理,并且基因组的其余部分可以快速卡入到位。OxfordNanoporeTechnologies还捕获了许多调节基因表达的DNA修饰,T2T合作使我们能够在基因组中绘制这些“表观遗传标记”。
蛋白质结构分析
过去两年,实验和计算的进步使研究人员能够以前所未有的速度和分辨率确定蛋白质结构。
英国DeepMind公司开发的AlphaFold2结构预测算法使用深度学习策略从氨基酸序列推断折叠蛋白质的形状。自2021年7月公开发布以来,AlphaFold2已应用于蛋白质组学研究,以确定人类和20种模式生物中表达的所有蛋白质的结构,并鉴定Swiss-Prot数据库中近440,000个蛋白质的结构。
与此同时,冷冻电镜的改进使研究人员能够通过实验解决最具挑战性的蛋白质及其复合物。2020年,两个团队实现了小于15埃的结构分辨率,使他们能够确定单个原子的位置。
同样令人感兴趣的是一种称为冷冻电子断层扫描的相关技术,它可以捕获冷冻细胞薄片中自然发生的蛋白质行为。
量子模拟
量子计算机以量子位的形式处理数据。几个研究团队已经成功地使用单个离子作为量子位,但它们的电荷使它们难以高密度组装。
法国国家科学研究中心的AntoineBrowaeys和哈佛大学的MikhailLukin等物理学家正在探索另一种方法。该团队使用光镊将不带电的原子精确地固定在紧密堆积的2D和3D阵列中,然后使用激光将这些粒子激发成大直径的里德伯原子,使它们与附近的原子纠缠在一起。
短短几年内,技术进步提高了里德堡原子阵列的稳定性和性能,量子比特的数量迅速从数十个扩展到数百个。Browaeys估计这些量子模拟器可以在一到两年内投入商业使用。这项工作也为量子计算机的更广泛应用铺平了道路。
精确的基因组控制
CRISPR-Cas9技术具有强大的基因组编辑能力,但更适合灭活基因而不是修复基因。美国哈佛大学化学生物学家刘汝谦指出,大多数遗传病需要基因纠正,而不是基因破坏。为了实现这一目标,刘汝谦的团队开发了两种有前途的方法。
第一种方法称为碱基编辑,将催化受损的Cas9与催化一种核苷酸化学转化为另一种核苷酸的酶结合起来。然而,该方法目前仅允许特定碱基之间的转换。第二种方法称为引导编辑,将Cas9连接到逆转录酶,并使用修改后的引导RNA将所需的编辑整合到基因组序列中。通过多步生化过程,这些成分将指导RNA复制到DNA中,最终替换目标基因组序列。
重要的是,这两种方法都只切割DNA的一条链。这是一个对细胞更安全、破坏性更小的过程。
靶向基因治疗
基于核酸的药物可能具有临床意义,但其应用的组织仍然存在许多。大多数治疗需要局部给药或从患者体内提取细胞,在体外处理,然后移植回患者体内。
腺相关病是许多基因治疗的首选载体。动物研究表明,通过仔细选择正确的病与组织特异性基因启动子相结合,可以将药物有效地输送到特定器官。然而,病有时很难大规模生产,并且会引发免疫反应,从而降低其有效性或引起副作用。
脂质纳米颗粒是非病载体,过去几年发表的几项研究表明,脂质纳米颗粒具有调节特异性的潜力。例如,美国德克萨斯大学西南医学中心生物化学家DanielSiegwart及其同事开发的选择性器官靶向技术,可以快速生成和筛选脂质纳米颗粒,以有效靶向组织细胞,有助于寻找可利用的纳米颗粒。
空间多组学
单细胞组学的发展使研究人员更容易从单个细胞获得遗传、转录、表观遗传和蛋白质组学的见解。然而,单细胞技术将细胞从其原始环境中移除,可能会错过重要信息。
2016年,瑞典皇家理工学院JoakimLundeberg团队提出了解决策略。该团队准备了带有条形码寡核苷酸的载玻片,这些寡核苷酸从完整的组织切片中捕获信使RNA,以便每个转录样本都可以根据条形码映射到样本中的特定位置。
从那时起,空间转录组学领域经历了爆炸性增长,现在有多种商业系统可用。研究团队还继续开发新方法,以更好的深度和空间分辨率绘制基因表达图谱。
基于CRISPR的诊断
CRISPR-Cas系统精确切割特定核酸序列的能力来自于其在细菌“免疫系统”中抵抗病感染的作用。这些联系激发了该技术的早期采用者考虑其在病诊断中的适用性。
尽管Cas9是基于CRISPR的基因组操作的首选酶,但大多数基于CRISPR的诊断研究都使用了称为Cas13的靶向RNA分子家族。这是因为Cas13不仅可以切割引导RNA靶向的RNA,还可以对附近的其他RNA分子进行“平行切割”。许多基于Cas13的诊断使用带有荧光标签的报告RNA,该荧光标签“连接”到抑制荧光的猝灭剂分子。当Cas13识别病RNA并被激活时,它会阻断报告基因并从猝灭剂中发出荧光标记,产生可检测的信号。有些病会发出强烈的信号,无需放大即可检测到,从而大大简化了现场诊断。
一、皮肤学最专业的大学?
皮肤学专业是临床医学一级学科下的二级学科,是以形态教育为主的临床学科。“皮肤学”领域探索和研究牛皮癣、遗传性皮肤病、性传播疾病、皮肤激光医学、麻风病等的诊断、治疗和病因学。
1-检测方法、UU及耐药性基因诊断、人体免疫缺陷病免疫、病原真菌及相关疾病研究-、2-SLE发病机制研究、3-皮肤病中西医治疗疾病综合治疗、4-美容医学研究。
4推荐大学编辑
A级院校北京大学、华中科技大学、哈尔滨医科大学、中国医科大学、南京医科大学、中南大学、安徽医科大学、复旦大学
B+等西安交通大学、中山大学、上海交通大学、四川大学、浙江大学、广西医科大学、南方医科大学、武汉大学、重庆医科大学、吉林大学、天津医科大学、首都医科大学
B级昆明医科大学、陕西医科大学、新疆医科大学、大连医科大学、兰州大学、山东大学、河北医科大学、暨南大学、同济大学、内蒙古医科大学
二、分子鉴定技术发展历程?
分子诊断技术是指以DNA、RNA为诊断材料,利用分子生物学技术检测基因的有无、缺陷、异常表达等来诊断人类状况和疾病的技术。通过检测DNA或RNA的结构、数量和表达功能的变化来判断基因水平上的异常变化的基本原理,对于疾病的预防、预测、诊断、治疗和预后具有重要意义。基于分子生物学水平的方法学技术是分子诊断技术,如PCR技术、基因测序技术等。
PCR技术(聚合酶链式反应)是一种用于扩增特定DNA片段的分子生物学技术,其基本原理与DNA的自然复制过程类似,由变性、退火和延伸三个基本反应步骤组成。模板DNA的变性、模板DNA和引物的退火和再生以及引物延伸。通过重复变性-退火-延伸三个过程,可以获得更多的“半维持复制链”,这些新链可以成为下一个循环的模板。每个循环需要2~4分钟完成,待扩增的目的基因可在2~3小时内扩增数百万倍。这个想法是由美国的穆利斯于1983年首先提出的。1985年,他发明了聚合酶链反应这种简单的DNA扩增方法,标志着PCR技术的真正诞生。简单来说,PCR技术本质上是扩增DNA片段,而实时荧光PCR技术可以检测样本中的DNA含量。
基因测序技术是确定DNA序列的技术。在分子生物学研究中,DNA序列分析是进一步研究和修饰目标基因的基础。目前用于测序的技术主要有Sanger等人发明的双脱氧链末端终止法和Maxam和Gilbert发明的化学消化法。这两种方法在原理上有很大不同,但都是基于从固定点开始并随机以特定碱基结束的核苷酸,产生四组不同长度的A、T、C和G。然后通过尿素变性PAGE凝胶上的电泳检测一系列核苷酸以获得DNA序列。目前广泛使用的是桑格测序法。简单来说,基因测序技术就是对DNA片段进行测序和分析,以明确DNA序列。
我们来回顾一下过去50年分子诊断技术的发展史。
1.基于分子杂交的分子诊断技术
20世纪60年代到80年代的20年是分子杂交技术发展最快的时期,当时不可能从样本中人工扩增目的基因,只能通过探针捕获并检测目的序列。已知基因序列。我能够做到。其中,液固相杂交基础理论、探针固定化包被技术和人工合成cDNA探针的出现,为基于分子杂交的体外诊断方法提供了初步的技术储备。
-一。Southernblot技术-Southernblot,
Southern[1]于1975年发明了Southern印迹技术,利用性内切酶将DNA片段化,利用凝胶电泳分离出不同长度的DNA片段,然后利用虹吸管或电压转移将其转移至醋酸纤维素膜上,这是一种使DNA变性的技术。分娩后膜上的DNA。然后用核素标记的寡核苷酸探针进行分子杂交,洗脱后用放射自显影技术确认探针与待测DNA片段之间的同源序列。由于DNA片段的同时酶消化和分子探针杂交,该方法确保了检测的特异性。因此一经推出,就成为探针杂交领域最经典的分子检测方法,广泛应用于各种基因突变的缺失、插入、易位以及性片段长度多态性等。性片段长度多态性RFLP,鉴定正在进行中。Alwine等人[2]于1977年推出了基于转移杂交的Northernblot技术,该技术成为当时RNA检测的标准。
-2。ASO反向斑点印迹-等位基因特异性寡核苷酸反向印迹,ASO-RDB;
利用核酸印迹技术检测核酸序列的杂交具有非常高的特异性,但缺点是操作非常繁琐、检测时间长。样品点样固定技术成立于1980年,消除了传统Southern印迹需要通过凝胶分离技术固定样品的缺点。通过将单碱基突变引入质粒载体,构建了第一个等位基因特异性寡核苷酸探针——ASO(一种等位基因特异性寡核苷酸),从而能够检测核酸序列中的点突变。1986年,Saiki等[3]将PCR的高灵敏度与ASO点杂交的高特异性相结合,首先实现了利用ASO探针对特异性基因多态性进行分型。后来,为了完成同一样本中多个分子标记的高通量检测,Saiki[4]发明了ASO-RDB,将生物素标记的特异性PCR扩增产物与膜固定化探针杂交。检测基因突变。该方法可将多种寡核苷酸探针固定在同一张膜条上,通过一次杂交反应即可筛选待测样品DNA中数十甚至数百个等位基因,操作简单、快速,因此,一度成为基因突变检测、基因分型、病原体筛查最常用的技术。
-3.荧光原位杂交-荧光原位杂交,FISH,
FISH起源于核素标记原位杂交技术,1977年Rudkin完成了首次使用荧光素标记探针的原位杂交尝试[5]。20世纪80年代和90年代,细胞遗传学和非同位素标记技术的发展使FISH在临床诊断中变得实用。与其他仅检测核酸序列的分子诊断技术相比,FISH结合了组织学定位的优势和探针的高特异性,可以检测和定位完整细胞或分离染色体中特定的正常或异常DNA序列。高能荧光素标记DNA探针,可使用多个荧光素标记同时检测多个目标。
如今,FISH被广泛应用于核型分析、基因扩增、基因重排、病原微生物鉴定等各个方面。比较基因组杂交——比较基因组杂交、CGH和光谱核型分析——通过光谱核型分析、SKY和其他FISH衍生技术在越来越多的临床诊断领域发挥着作用。
-4。多重连接探针扩增技术-多重连接依赖性探针扩增,MLPA,
MLPA技术由Schouten等人[6]于2002年首次报道。每个MLPA探针包含两个荧光标记的寡核苷酸片段,一个是化学合成的,另一个是通过M13噬菌体诱导方法制备的,并且每个探针包含引物序列和特定序列。在MLPA反应中,两个寡核苷酸片段均与靶序列杂交,并使用连接酶连接两个探针。连接反应具有高度特异性两个探针必须与目标序列完全杂交,然后连接酶才能将它们连接成完整的单链核酸。仅一个碱基的差异就会导致不完全杂交和反向连接。
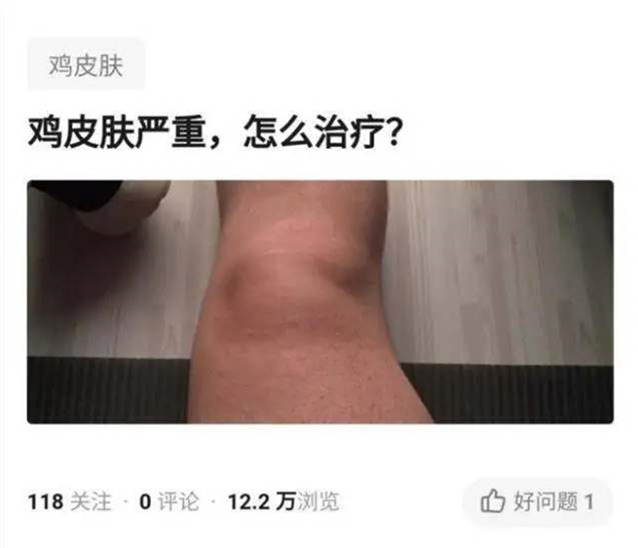
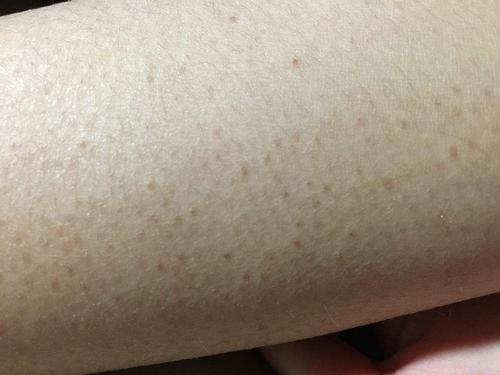
遗传鸡皮肤可激光吗和表观遗传鸡皮肤激光这种话题就介绍到这儿了,如果本文对各位有所帮助,请持续关注并收藏本站吧。