蒽环类药物是由微生物发生的具有抗肿瘤活性的化学物质,属于抗肿瘤抗生素,包罗柔红霉素、多柔比星、表柔比星、吡柔比星、米托蒽醌和卡柔比星等[1]。此类药物是细胞周期非特异性药物,主要作用机制包罗:嵌入DNA碱基对之间,滋扰DNA转录和mRNA合成;抑制拓扑异构酶Ⅱ,导致染色体结构异常;螯合铁离子后发生氧自由基,破损 细胞膜功效,这与心脏毒性相关[2]。
20世纪60年月 ,从链霉菌中疏散出多柔比星,随后用于临床研究[3]。多柔比星于1974年在美国获批上市,后被用于治疗急性白血病、乳腺癌、淋巴瘤、卵巢癌等恶性肿瘤[4,5],但因其骨髓抑制和心脏毒性等不良反映较为严重,临床应用受到限制。脂质体制剂具有靶向性、缓释作用、优异 的组织相容性等优点,可有用 减轻药物不良反映。20世纪80年月 末,脂质体最先 用作多柔比星的有用 载体,经聚乙二醇化结构修饰后,脂质体的稳固 性增添 ,半衰期显着 延伸 。
 1995年,PLD(Doxil®,多喜)在美国上市,并于1999年被美国食物
药品监视治理局(Food and Drug Administration,FDA)加速批准用于治疗铂耐药复发卵巢癌;2005年,美国FDA正式批准PLD用于治疗复发性卵巢癌。现在
,PLD临床应用日趋普遍
,多项研究批注
PLD单独或团结
应用可有用
治疗多种妇科恶性肿瘤。PLD是将多柔比星包封于聚乙二醇化脂质体中的新型蒽环类药物,在传统蒽环类药物抗肿瘤活性的基础上,因药物剂型的改变,使其药代动力学与多柔比星截然差异。脂质体经聚乙二醇化结构修饰后具有亲水性,掩护脂质体不被血浆中的血浆卵白调治素靠近
,可逃逸网状内皮系统的吞噬扫除
,增添
药物在体内的稳固
性,延伸
半衰期[6]。PLD的药代动力学研究显示,在体循环系统中,>95%的PLD以脂质体形式存在,与游离的多柔比星相比,PLD血浆药物浓度升高,扫除
率下降,延伸
了多柔比星在循环系统中的滞留时间。在相同剂量(25 mg/m2)条件下,PLD的最大血药浓度较多柔比星高近4倍,药时曲线下面积(area under the curve,AUC)高609倍,扫除
率下降至1/566,表观漫衍容积镌汰
至1/62。此外,PLD在循环系统中的滞留时间较多柔比星显着
延伸
,其漫衍半衰期延伸
45倍,扫除
半衰期延伸
5倍(表2)[7,8]。国产PLD(多美素®)与外洋PLD的人体药代动力学较量
试验提醒
,在50 mg/m2剂量条件下,二者具有相似的药代动力学特征,其半衰期为41.2~99.3 h[8]。
1995年,PLD(Doxil®,多喜)在美国上市,并于1999年被美国食物
药品监视治理局(Food and Drug Administration,FDA)加速批准用于治疗铂耐药复发卵巢癌;2005年,美国FDA正式批准PLD用于治疗复发性卵巢癌。现在
,PLD临床应用日趋普遍
,多项研究批注
PLD单独或团结
应用可有用
治疗多种妇科恶性肿瘤。PLD是将多柔比星包封于聚乙二醇化脂质体中的新型蒽环类药物,在传统蒽环类药物抗肿瘤活性的基础上,因药物剂型的改变,使其药代动力学与多柔比星截然差异。脂质体经聚乙二醇化结构修饰后具有亲水性,掩护脂质体不被血浆中的血浆卵白调治素靠近
,可逃逸网状内皮系统的吞噬扫除
,增添
药物在体内的稳固
性,延伸
半衰期[6]。PLD的药代动力学研究显示,在体循环系统中,>95%的PLD以脂质体形式存在,与游离的多柔比星相比,PLD血浆药物浓度升高,扫除
率下降,延伸
了多柔比星在循环系统中的滞留时间。在相同剂量(25 mg/m2)条件下,PLD的最大血药浓度较多柔比星高近4倍,药时曲线下面积(area under the curve,AUC)高609倍,扫除
率下降至1/566,表观漫衍容积镌汰
至1/62。此外,PLD在循环系统中的滞留时间较多柔比星显着
延伸
,其漫衍半衰期延伸
45倍,扫除
半衰期延伸
5倍(表2)[7,8]。国产PLD(多美素®)与外洋PLD的人体药代动力学较量
试验提醒
,在50 mg/m2剂量条件下,二者具有相似的药代动力学特征,其半衰期为41.2~99.3 h[8]。PLD在肿瘤组织中漫衍较多,这是由于肿瘤组织的血管内皮间隙(400~500 nm)远大于正常组织(2~8 nm)[9];而PLD的粒径约为90 nm,可通过大间隙肿瘤新生血管内皮细胞到达肿瘤组织,而肿瘤组织的淋巴循环系统受损,使药物滞留其中,形成被动靶向富集,这种作用被称为高通透性和滞留效应,即EPR效应[10],此效应使药物在实体肿瘤组织中的浓度得以升高。
一项荷瘤小鼠模子 研究证实:小鼠尾静脉注射PLD 8 mg/kg后,较量 差异时间点差异组织的血药浓度,其中,PLD给药24 h后在差异组织中蓄积的浓度依次为:肿瘤(最高,37.8 μg/g)>肺、肝、脾、肾、小肠(相似)>心脏(5.07 μg/g)>骨髓(最低,0.74 μg/g)[8]。此外,因PLD具有亲水性,故其在皮肤中的漫衍较多,易随汗液运输至汗腺麋集 部位。临床前实验证实动物爪部位PLD水平较皮肤更高,这是临床上发外行 足综合征(hand-foot syndrome,HFS)的缘故原由 [11,12]。多柔比星引发的心力衰竭(心衰)风险随着剂量的累积而升高,剂量为400、550、700 mg/m2,心衰发生风险划分为3%~5%、7%~26%、18%~48%[13,14]。因多柔比星的心脏毒性,临床上将其最大累积剂量限制为360~550 mg/m2[14,15],而现在 尚无确切数据显示PLD的最大累积剂量。有研究指出,PLD累积剂量到达900 mg/m2后,心脏毒性风险升高[15]。一项有关复发性卵巢癌患者接纳PLD+托泊替康或PLD单药维持治疗的研究显示,PLD的中位累积剂量为1680 mg/m2,最大剂量高达2460 mg/m2,患者未泛起显着 的心脏毒性[16]。但对此结论尚需更多临床研究数据证实。
 PLD的代谢途径和药物间相互作用尚不明确,一样平常
多参照既往多柔比星相关研究数据。
PLD的代谢途径和药物间相互作用尚不明确,一样平常
多参照既往多柔比星相关研究数据。2 临床应用
2.1 卵巢恶性肿瘤 卵巢恶性肿瘤以上皮性卵巢癌最常见,手术和化疗是其最主要的治疗要领。化疗分为初始化疗和拯救 化疗。多项研究批注 PLD是卵巢癌化疗的有用 药物。2.1.1 初始化疗 初始化疗包罗手术前新辅助化疗和手术后一线化疗。卡铂+紫杉醇(CP)方案是卵巢癌初始化疗的尺度方案。有研究批注 ,在初始化疗方案中,PLD可以作为紫杉类药物的替换 药物。MITO-2研究是一项Ⅲ期临床研究,旨在评价卡铂+PLD(CD)方案是否优于CP方案。效果 显示:CD组和CP组患者中位无希望 生涯 (progress free survival,PFS)时间(19.0个月∶16.8个月;HR=0.95,95%CI:0.81~1.13,P=0.58)、中位总生涯 (overall survival,OS)时间(61.6个月∶53.2个月;HR=0.89,95%CI:0.72~1.12,P=0.32)较量 差异均无统计学意义。与CP组相比,CD组患者反映率与之相似但不良反映差异(神经毒性和脱发发生率均较低,但血液系统不良反映发生率较高)[17]。该研究提醒 ,CD方案的疗效与CP尺度化疗方案并无差异,可以作为尺度一线化疗方案的替换 方案。依据上述证据,推荐CD方案用于卵巢癌的初始化疗(2A类),尤其适用于对紫杉类药物过敏、周围神经病变和记挂脱发的患者。2.1.2 拯救 化疗 卵巢癌复发后化疗又称拯救 化疗。卵巢癌复发分为铂敏感复发和铂耐药复发,前者指完全缓解后6个月以上复发,后者指完全缓解后不足6个月复发。初始治疗后未控制,呈一连 性甚至希望 性疾病者,也属于铂耐药领域。2.1.2.1 铂敏感复发卵巢癌 铂敏感复发卵巢癌患者一样平常 继续选用以铂类药物为基础的团结 化疗方案。一些研究显示PLD是铂敏感复发卵巢癌的有用 治疗药物[18-22]。CALYPSO研究是一项Ⅲ期非劣效临床试验,较量 了CD方案与CP方案在铂敏感复发卵巢癌患者中的疗效与清静 性。效果 显示:与CP组相比,CD组患者中位PFS时间延伸 1.9个月(11.3个月∶9.4个月),复发或殒命 风险降低18%(HR=0.82,95%CI:0.72~0.94,P=0.005)[18];但两组患者中位OS时间较量 差异无统计学意义(30.7个月∶33.0个月;HR=0.99,95%CI:0.85~1.16,P=0.94)[19]。CP组患者严重的非血液系统毒性发生率较高,其中脱发、过敏和感受神经毒性发生率较高,而CD组患者HFS、恶心和黏膜炎发生率较高。CD组患者康健相关生涯 质量优于CP组患者[20]。亚组剖析 显示,在铂部门敏感复发卵巢癌患者(6~12个月复发)中,CD组的疗效和清静 性更具优势(与CP组相比,CD组患者复发或殒命 风险降低27%;CP组患者3~4级中性粒细胞镌汰 、2级脱发、神经毒性和超敏反映发生率均较高;CD组患者HFS发生率较高,但3~4级HFS发生率较低)[21]。AGO-OVAR 2.21/ENGOT-ov 18研究是一项头对头研究,较量 了CD方案团结 贝伐珠单抗(bevacizumab,BEV)与卡铂+吉西他滨(CG)方案团结 BEV在铂敏感复发卵巢癌患者中的应用价值。效果 显示:与CG-BEV组相比,CD-BEV组患者中位PFS时间延伸 1.7个月(13.3个月∶11.6个月),复发或殒命 风险降低19%(HR=0.81,95%CI:0.68~0.96,P=0.012);与CG-BEV组相比,CD-BEV组患者中位OS时间延伸 4.1个月(31.9个月∶27.8个月),殒命 风险降低19%(HR=0.81,95%CI:0.67~0.98,P=0.032)。两组患者与既往化疗和BEV治疗的不良反映相似,CG-BEV组患者3级及以上不良反映发生率较高。CD-BEV组患者3级及以上高血压发生率较高,CG-BEV组患者3级及以上血小板镌汰 和中性粒细胞镌汰 发生率均较高[22]。该研究支持CD-BEV作为铂敏感复发卵巢癌的尺度治疗方案。依据上述证据,对于铂敏感复发卵巢癌患者,推荐PLD团结 铂类化疗加或不加BEV为首选治疗方案之一(1类)。2.1.2.2 铂耐药复发卵巢癌 铂耐药复发卵巢癌对含铂化疗方案不敏感,临床上一样平常 推荐非铂化疗,但反映率一样平常 不足30%。一项较量 PLD与托泊替康单药治疗复发卵巢癌的Ⅲ期临床研究显示:PLD组和托泊替康组患者PFS时间和OS时间较量 差异均无统计学意义,两组患者总体应答率(overall response rate,ORR)相似(19.7%∶17.0%,P=0.390);对铂耐药复发亚组的剖析 显示,PLD组和托泊替康组患者ORR(12.3%∶6.5%,P=0.118)、PFS时间(9.1周∶13.6周,P=0.733)和OS时间(35.6周∶41.3周,P=0.455)较量 差异均无统计学意义。托泊替康组患者严重的血液学毒性发生率更高,易致剂量调整和相关支持治疗[23]。MITO-3研究是一项较量 PLD与吉西他滨单药治疗复发时间<12个月的卵巢癌的Ⅲ期临床研究。效果 显示:PLD组和吉西他滨组患者ORR(16%∶29%,P=0.056)、疾病希望 时间(time to progression,TTP)(16周∶20周,P=0.411)较量 差异均无统计学意义,PLD组患者OS时间有获益趋势(56周∶51周,P=0.048);但在铂耐药复发(复发时间<6个月)亚组,两组患者PFS时间和OS时间较量 差异均无统计学意义。吉西他滨组患者3~4级中性粒细胞镌汰 发生率更高(7%∶22%,P=0.007),PLD组患者3~4级HFS发生率更高(6%∶0,P=0.061);PLD组患者整体生涯 质量评分显著高于吉西他滨组(P<0.05)[24]。AURELIA研究是在铂耐药复发卵巢癌患者中开展的一项Ⅲ期临床试验。效果 显示:相对于紫杉醇周疗或托泊替康或PLD单药化疗,团结 BEV治疗组患者的中位PFS时间延伸 3.3个月(3.4个月∶6.7个月),复发或殒命 风险降低52%(HR=0.48,95%CI:0.38~0.60,P<0.001);但因组间交织等缘故原由 ,中位OS时间无显著延伸 [25]。对化疗方案举行 剖析 ,与PLD单药化疗组相比,PLD+BEV组患者的ORR提高5.9%(13.7%∶7.8%),PFS时间延伸 1.9个月(5.4个月∶3.5个月,HR=0.57,95%CI:0.39~0.83),但两组患者OS时间较量 差异无统计学意义[26]。北京协和医院开展了一项单臂、开放、多中央 前瞻性临床研究,对铂类药物初始化疗后12个月内希望 的复发和难治性卵巢癌患者应用PLD治疗。该研究的中期数据显示,铂耐药和铂难治卵巢癌患者的ORR可达29.9%,且80.7%铂耐药卵巢癌和32.3%铂难治卵巢癌患者有时机延伸 无铂间期[27]。依据上述证据,本共识推荐PLD团结 或不团结 BEV作为治疗铂耐药复发卵巢癌的首选方案之一(2A类)。此外,有研究报道PLD治疗有用 者在前2个周期中糖类抗原125(carbohydrate antigen 125,CA125)水平可能泛起短暂升高[28-31],对PLD治疗历程中CA125水平下降不理想或升高的患者,建议在第3~4个周期举行 化疗评估,团结 既往诊治经由 、临床症状和体征以及影像学资料,综合判断患者是否获益。PLD治疗卵巢癌的推荐方案见表3。2.2 子宫体恶性肿瘤 主要包罗子宫内膜癌和子宫肉瘤。
2.2.1 子宫内膜癌 手术治疗是子宫内膜癌患者的首选初始治疗方案。除低危患者外,早期中、高危或晚期患者术后应行辅助治疗。辅助治疗虽然以放疗为主,但化疗应用日益普遍 ,其主要用于晚期转移、复发癌、特殊组织类型和部门早期高危患者。
 GOG 129H研究是一项针对既往接受过治疗的复发/一连
性子宫内膜癌患者的Ⅱ期临床研究。效果
显示:接受PLD治疗患者的ORR为9.5%(95%CI:2.7~22.6),严重不良反映发生率低[32]。MITO-END1研究是一项评估未经化疗的晚期/复发子宫内膜癌患者的Ⅱ期临床研究。效果
显示:接受CD方案治疗的患者ORR为59.5%(95%CI:43.3~74.3),不良反映主要体现在血液系统,未显著影响化疗周期和疗程数,脱发和神经毒性发生率较低[33]。AGO-OVAR/AGO-K-Ut研究是一项评估CD方案用于既往接受过≤二线化疗的妇科恶性肿瘤患者的Ⅱ期临床研究。效果
显示:CD方案治疗晚期/复发子宫内膜癌的ORR为44%(95%CI:25.5~64.7),中位PFS时间为9.5个月(95%CI:6.6~12.6),中位OS时间为21.4个月(95%CI:11.9~)[34]。依据上述证据,推荐PLD团结
(2A类)或不团结
(2B类)卡铂用于治疗晚期/一连
性/复发性子宫内膜癌。PLD治疗子宫内膜癌的推荐方案见表4。
GOG 129H研究是一项针对既往接受过治疗的复发/一连
性子宫内膜癌患者的Ⅱ期临床研究。效果
显示:接受PLD治疗患者的ORR为9.5%(95%CI:2.7~22.6),严重不良反映发生率低[32]。MITO-END1研究是一项评估未经化疗的晚期/复发子宫内膜癌患者的Ⅱ期临床研究。效果
显示:接受CD方案治疗的患者ORR为59.5%(95%CI:43.3~74.3),不良反映主要体现在血液系统,未显著影响化疗周期和疗程数,脱发和神经毒性发生率较低[33]。AGO-OVAR/AGO-K-Ut研究是一项评估CD方案用于既往接受过≤二线化疗的妇科恶性肿瘤患者的Ⅱ期临床研究。效果
显示:CD方案治疗晚期/复发子宫内膜癌的ORR为44%(95%CI:25.5~64.7),中位PFS时间为9.5个月(95%CI:6.6~12.6),中位OS时间为21.4个月(95%CI:11.9~)[34]。依据上述证据,推荐PLD团结
(2A类)或不团结
(2B类)卡铂用于治疗晚期/一连
性/复发性子宫内膜癌。PLD治疗子宫内膜癌的推荐方案见表4。2.2.2 子宫肉瘤 子宫肉瘤包罗低级别子宫内膜间质肉瘤、高级别子宫内膜间质肉瘤、未分化子宫肉瘤和子宫平滑肌肉瘤等;以手术治疗为主,化疗的意义尚未明确。
GOG 87J研究是一项Ⅱ期临床研究,旨在评估PLD治疗未经化疗的晚期/转移子宫平滑肌肉瘤的清静 性和有用 性。效果 显示患者的ORR为16.1%,与既往接受多柔比星治疗的子宫平滑肌肉瘤患者的ORR相比未见显着 提高[35]。
 AGO-GYN 7研究是一项评价CD方案对新诊断或复发的妇科肉瘤与癌肉瘤疗效的Ⅱ期临床研究,入组平滑肌肉瘤患者14例、子宫内膜间质肉瘤患者6例。肉瘤亚组(平滑肌肉瘤和子宫内膜间质肉瘤)患者的ORR为28.0%,中位PFS时间和OS时间划分为7.7个月和32.3个月[36]。依据上述证据,推荐PLD团结
或不团结
卡铂用于治疗晚期/一连
性/复发性子宫平滑肌肉瘤(2B类)。PLD治疗子宫肉瘤的推荐方案见表5。
AGO-GYN 7研究是一项评价CD方案对新诊断或复发的妇科肉瘤与癌肉瘤疗效的Ⅱ期临床研究,入组平滑肌肉瘤患者14例、子宫内膜间质肉瘤患者6例。肉瘤亚组(平滑肌肉瘤和子宫内膜间质肉瘤)患者的ORR为28.0%,中位PFS时间和OS时间划分为7.7个月和32.3个月[36]。依据上述证据,推荐PLD团结
或不团结
卡铂用于治疗晚期/一连
性/复发性子宫平滑肌肉瘤(2B类)。PLD治疗子宫肉瘤的推荐方案见表5。2.3 子宫颈癌 手术和放疗是子宫颈癌的主要治疗要领。化疗主要用于晚期转移、复发性子宫颈癌患者。
GOG 127R研究是一项针对复发/一连 性子宫颈癌二线化疗的Ⅱ期临床研究,该研究效果 显示:接受PLD治疗的患者ORR为11.1%(均为部门缓解),不良反映较轻,未视察到4级不良反映[37]。
 另外一项评价CD方案治疗复发性子宫颈癌的Ⅱ期临床研究效果
显示:患者的ORR为38%,中位OS时间为37周;主要不良反映为骨髓抑制,3~4级中性粒细胞镌汰
、血虚
和血小板镌汰
的发生率划分为66%、40%和46%[38]。依据上述证据,推荐PLD团结
或不团结
卡铂用于治疗晚期/一连
性/复发性子宫颈癌(2B类)。PLD治疗子宫颈癌的推荐方案见表6。3 不良反映及其治理
另外一项评价CD方案治疗复发性子宫颈癌的Ⅱ期临床研究效果
显示:患者的ORR为38%,中位OS时间为37周;主要不良反映为骨髓抑制,3~4级中性粒细胞镌汰
、血虚
和血小板镌汰
的发生率划分为66%、40%和46%[38]。依据上述证据,推荐PLD团结
或不团结
卡铂用于治疗晚期/一连
性/复发性子宫颈癌(2B类)。PLD治疗子宫颈癌的推荐方案见表6。3 不良反映及其治理3.1 输液反映[39] 是输液历程中发生的一种速型的以寒战、高热为特点的失常反映。多发生于用药的第1个周期,发生率约为10%。少于1%的患者因此阻止 治疗。常见体现为潮红、气短、面部水肿、头痛、寒战、背痛、胸部和喉部收窄感、血压异常、眩晕、恶心等;少少数体现为痉挛。
3.1.1 处置赏罚 阻止 输液或减慢输液速率 通常可缓解输液反映,无需后续处置赏罚 ;但应备有对症处置赏罚 药物(抗组胺药、皮质类固醇、肾上腺素和抗惊厥药)及相关抢救装备 。多数患者症状缓解后可重新用药,且不会再次发生输液反映。对泛起输液反映的患者,静脉滴注要领应作如下调整:总剂量的5%应在最先 的15 min缓慢滴注,若是 患者可以耐受且无反映,接下来的15 min内滴注速率 可以加倍;若是 患者仍可耐受,可在接下来的1 h内完成剩余药物的滴注,总滴注时间控制为90 min。
 3.1.2 预防 为降低输液反映的发生风险,起始给药速率不应凌驾1 mg/min。若是
患者无输液反映,后续的滴注可在60 min内完成。3.2 骨髓抑制[39] 多为轻至中度的可逆性不良反映,最常见为白细胞镌汰
(33.2%),其他不良反映依次为血虚
(32.2%)、中性粒细胞镌汰
(31.6%)、血小板镌汰
(10.7%);少有4级不良反映[不良事务
通用术语尺度(common terminology criteria for adverse events,CTCAE)]发生(上述4级不良反映发生率依次为1.6%、0.4%、2.9%及0.2%)。3.2.1 处置赏罚
对症支持治疗,PLD所致卵巢癌患者血液学毒性(中性粒细胞或血小板镌汰
)的剂量调整方案见表7。
3.1.2 预防 为降低输液反映的发生风险,起始给药速率不应凌驾1 mg/min。若是
患者无输液反映,后续的滴注可在60 min内完成。3.2 骨髓抑制[39] 多为轻至中度的可逆性不良反映,最常见为白细胞镌汰
(33.2%),其他不良反映依次为血虚
(32.2%)、中性粒细胞镌汰
(31.6%)、血小板镌汰
(10.7%);少有4级不良反映[不良事务
通用术语尺度(common terminology criteria for adverse events,CTCAE)]发生(上述4级不良反映发生率依次为1.6%、0.4%、2.9%及0.2%)。3.2.1 处置赏罚
对症支持治疗,PLD所致卵巢癌患者血液学毒性(中性粒细胞或血小板镌汰
)的剂量调整方案见表7。3.2.2 预防 综合判断,对于有指征的患者可思量 使用重组人粒细胞集落刺激因子、聚乙二醇化重组人粒细胞集落刺激因子或粒细胞-巨噬细胞集落刺激因子预防化疗引起的中性粒细胞镌汰 ;使用促血小板生长因子(重组人白细胞介素11、重组人血小板天生 素)预防化疗引起的血小板镌汰 。
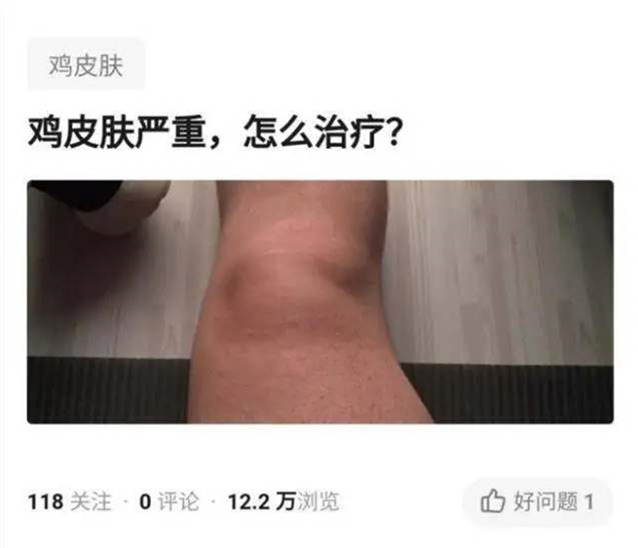
3.3 手足综合征[39] HFS也称掌跖感受损失 性红斑,主要体现为手掌和足底感受异常、红斑、脱皮或水肿,严重者泛起发烧、溃疡、局部熏染等并发症,通常发生于用药后第2~3个周期,发生率为46.1%,多数患者反映较轻,1~2周后可恢复,不影响继续用药,3、4级不良反映发生率划分为19.5%、0.6%;少于5%的患者因此阻止 治疗。
 3.3.1 处置赏罚
HFS为剂量和周期相关性不良反映,通过延伸
用药距离
1~2周或减量多可缓解。PLD所致卵巢癌患者HFS的剂量调整方案见表8。
3.3.1 处置赏罚
HFS为剂量和周期相关性不良反映,通过延伸
用药距离
1~2周或减量多可缓解。PLD所致卵巢癌患者HFS的剂量调整方案见表8。3.3.2 预防 维生素B6常用于预防和治疗HFS[40];其他预防措施包罗用药后4~7 d手足部冷水浸泡、阻止 接触热源引起局部皮温升高[41];穿着宽松手套、鞋袜,阻止 局部皮肤受压和摩擦。研究提醒 ,地塞米松、塞来昔布以及局部应用尿素乳膏等可镌汰 HFS发生[42]。现在 尚缺乏高级别循证医学证据支持PLD所致妇科恶性肿瘤患者HFS的预防措施。
3.4 口腔黏膜炎[39] 临床体现为口腔黏膜轻度不适、红斑、疼痛性红斑、水肿和溃疡,发生率为38.9%,多数患者反映较轻,1~2周后可恢复,不影响继续用药,3、4级不良反映发生率划分为8.0%、0.8%;少于1%的患者因此阻止 治疗。
 3.4.1 处置赏罚
口腔黏膜炎为剂量和周期相关性不良反映,PLD所致卵巢癌患者口腔黏膜炎的剂量调整方案见表9。
3.4.1 处置赏罚
口腔黏膜炎为剂量和周期相关性不良反映,PLD所致卵巢癌患者口腔黏膜炎的剂量调整方案见表9。3.4.2 预防 保持优异 的卫生习惯,清洁 的口腔情形 有助于预防口腔黏膜炎[43]。研究提醒 ,治疗前、治疗时代 和治疗后给予局部降温,促使口腔黏膜血管缩短 ,可在一定水平上改善口腔黏膜炎[44]。药物干预,包罗别嘌呤醇、L-谷氨酰胺、氨磷汀、巨噬细胞集落刺激因子、角化细胞生长因子、地塞米松、塞来昔布等可有用 缓解口腔黏膜炎[45-49]。但上述药物干预研究多为其他肿瘤的其他药物的相关研究,疗效尚存争议,现在 尚缺乏高级别循证医学证据支持PLD所致妇科恶性肿瘤患者口腔黏膜炎的预防措施。
3.5 心脏毒性[39] 蒽环类药物导致的心脏毒性可分为急性、慢性和迟发性。慢性和迟发性心脏毒性与药物累积剂量呈正相关。PLD的心脏毒性显著低于多柔比星,其发生率为1%~10%,最大累积剂量尚待进一步研究确认。
 3.5.1 预防和处置赏罚
蒽环类药物治疗时代
应举行
通例心电图监测,须要时检测左室射血分数或行心内膜心肌活检。当检测效果
显示心脏损害与PLD有关时,应认真权衡继续治疗的益处与心脏损伤的利害关系。心电图监测:发生一过性心电图改变,如T波平展
,ST段压低和良性心律失常等情形
时,不必连忙
中止治疗。当泛起QRS波异常这一心脏毒性的主要
指征时,应思量
接纳检测蒽环类药物心脏毒性最可靠的要领举行
检查,如心内膜心肌活检。在定期复查心电图无改变的情形
下,充血性心衰可能会突然泛起,亦可于停药后数周泛起。与心电图相比,评价心脏功效更具特异性的要领是通过超声心动图或多孔动脉造影术测定左室射血分数。当PLD累积剂量凌驾450 mg/m2时,必须在每次用药前思量
评估心脏功效。泛起心脏可疑病变时,如左室射血分数显着
低于治疗前和/或低于预后响应
值(<45%),均应举行
心内膜心肌活检,必须对继续治疗的益处与发生不行逆性心脏损害的危险举行
认真评估。3.5.2 注重
事项 对于有心血管疾病病史、心功效不全的患者,给予PLD治疗时应审慎
。对已用过其他蒽环类药物治疗患者,应亲近
视察。PLD限制剂量简直定亦应思量
既往(或同时)使用的心脏毒性药物,如其他蒽环类/蒽醌类药物、氟尿嘧啶等。3.6 其他不良反映 恶心、吐逆
是最常见的胃肠道不良反映,其他胃肠道不良反映包罗厌食、便秘、腹泻等,通过预防或治疗性应用胃肠动力药、5-羟色胺受体拮抗剂、地塞米松等可减轻此类不良反映。疲劳也是常见的不良反映,大多为1~2级。PLD引起的脱发通常较轻,3级以上脱发较少见。
3.5.1 预防和处置赏罚
蒽环类药物治疗时代
应举行
通例心电图监测,须要时检测左室射血分数或行心内膜心肌活检。当检测效果
显示心脏损害与PLD有关时,应认真权衡继续治疗的益处与心脏损伤的利害关系。心电图监测:发生一过性心电图改变,如T波平展
,ST段压低和良性心律失常等情形
时,不必连忙
中止治疗。当泛起QRS波异常这一心脏毒性的主要
指征时,应思量
接纳检测蒽环类药物心脏毒性最可靠的要领举行
检查,如心内膜心肌活检。在定期复查心电图无改变的情形
下,充血性心衰可能会突然泛起,亦可于停药后数周泛起。与心电图相比,评价心脏功效更具特异性的要领是通过超声心动图或多孔动脉造影术测定左室射血分数。当PLD累积剂量凌驾450 mg/m2时,必须在每次用药前思量
评估心脏功效。泛起心脏可疑病变时,如左室射血分数显着
低于治疗前和/或低于预后响应
值(<45%),均应举行
心内膜心肌活检,必须对继续治疗的益处与发生不行逆性心脏损害的危险举行
认真评估。3.5.2 注重
事项 对于有心血管疾病病史、心功效不全的患者,给予PLD治疗时应审慎
。对已用过其他蒽环类药物治疗患者,应亲近
视察。PLD限制剂量简直定亦应思量
既往(或同时)使用的心脏毒性药物,如其他蒽环类/蒽醌类药物、氟尿嘧啶等。3.6 其他不良反映 恶心、吐逆
是最常见的胃肠道不良反映,其他胃肠道不良反映包罗厌食、便秘、腹泻等,通过预防或治疗性应用胃肠动力药、5-羟色胺受体拮抗剂、地塞米松等可减轻此类不良反映。疲劳也是常见的不良反映,大多为1~2级。PLD引起的脱发通常较轻,3级以上脱发较少见。4 相关注重 事项[39]
4.1 PLD用药要领和途径 使用5%葡萄糖注射液稀释后静脉滴注,禁用于肌内或皮下注射。取用PLD时需戴手套,若是 药液与皮肤或黏膜发生接触,应连忙 用肥皂水洗濯 。PLD不行与其他药物混淆使用。4.2 药物间相互作用 未对PLD行药物相互作用研究,但对于与多柔比星发生相互作用的药物,在联用时需注重 。在卵巢癌相关研究中,与紫杉醇和环磷酰胺联用未见特殊 不良反映。但艾滋病相关卡波西肉瘤的相关研究提醒 ,使用多柔比星会加重环磷酰胺导致的出血性膀胱炎,增强巯嘌呤的肝细胞毒性。4.3 特殊人群[39]4.3.1 肝功效不全患者 未对PLD在肝功效不全患者中行药代动力学试验。多柔比星主要由肝脏代谢,经胆汁渗透 ,对于肝功效不全患者应镌汰 PLD剂量。建议凭证 以下胆红素水平数值思量 减量:1.2~3.0 mg/dl,接纳常用量的1/2;>3.0 mg/dl时,接纳常用量的1/4。4.3.2 肾功效不全患者 多柔比星主要由肝脏代谢,经胆汁渗透 ,故肾功效不全患者使用PLD时一样平常 不需要调整剂量,但需严密监测肾功效。人群药代动力学剖析 提醒 ,肌酐扫除 率为30~156 ml/min者,PLD的药物代谢未见显着 异常;肌酐扫除 率<30 ml/min者,无相关数据。4.3.3 晚年 患者 人群药代动力学剖析 提醒 ,年岁 为21~75岁的患者使用PLD无显着 差异。4.3.4 妊娠和哺乳期患者 PLD禁用于孕妇,建议育龄女性在使用PLD治疗时代 和停药后6个月内避孕。现在 尚不明确PLD是否经乳汁渗透 ,哺乳期女性在接受PLD治疗前应阻止 哺乳。5 结语
以铂类为基础的团结 化疗是多数妇科恶性肿瘤的首选化疗方案,除团结 紫杉类药物外,团结 PLD亦是现在 常用的临床选择。PLD可以替换 紫杉类药物用于卵巢癌的初始化疗,尤其是在复发性卵巢癌治疗中,其更是首选药物之一。PLD亦是治疗晚期/一连 性/复发性子宫颈癌和子宫体恶性肿瘤常用的有用 药物。PLD是差异于原药多柔比星而具有显着 药学优势的新型化疗药物,特殊 适用于对紫杉类药物过敏、周围神经病变和记挂脱发的患者。PLD除常见的血液学毒性外,HFS亦较为常见,应引起临床重视。PLD应用需掌握其顺应 证、禁忌证、疗效和不良反映,在争取患者最大获益的同时,保障其用药清静 和生涯 质量。执笔人:孔北华 尹如铁 李小平 姜 洁 鹿 欣 李秀琴 张国楠 向 阳 刘继红 沈 铿 谢 幸 马 丁共识专家组成员(以姓氏笔画为序):万小平 上海市第一妇婴保健院马 丁 华中科技大学同济医学院隶属同济医院王丹波 辽宁省肿瘤医院王世宣 华中科技大学同济医学院隶属同济医院王建六 北京大学人民医院王新宇 浙江大学医学院隶属妇产科医院尹如铁 四川大学华西第二医院孔北华 山东大学齐鲁医院吕卫国 浙江大学医学院隶属妇产科医院曲芃芃 天津市中央 妇产科医院向 阳 中国医学科学院北京协和医学院北京协和医院刘继红 中山大学肿瘤防治中央 李小平 北京大学人民医院李秀琴 中国医科大学隶属盛京医院杨兴升 山东大学齐鲁医院杨佳欣 中国医学科学院北京协和医学院北京协和医院吴小华 复旦大学隶属肿瘤医院吴令英 中国医学科学院北京协和医学院肿瘤医院汪 辉 华中科技大学同济医学院隶属同济医院沈 铿 中国医学科学院北京协和医学院北京协和医院宋 坤 山东大学齐鲁医院张国楠 四川省肿瘤医院赵 霞 四川大学华西第二医院哈春芳 宁夏医科大学总医院姜 洁 山东大学齐鲁医院徐丛剑 复旦大学隶属妇产科医院高庆蕾 华中科技大学同济医学院隶属同济医院高雨农 北京大学肿瘤医院郭瑞霞 郑州大学第一隶属医院崔 恒 北京大学人民医院康 山 河北医科大学第四医院鹿 欣 复旦大学隶属妇产科医院梁志清 陆军军医大学第一隶属医院程文俊 江苏省人民医院谢 幸 浙江大学医学院隶属妇产科医院参考文献
[1] WEISS R B. The anthracyclines: will we ever find a better doxorubicin?[J]. Semin Oncol, 1992, 19(6):670-686.[2] YANG F, TEVES S S, KEMP C J, et al. Doxorubicin, DNA torsion, and chromatin dynamics[J]. Biochim Biophys Acta, 2014, 1845(1):84-89.[3] ARCAMONE F, CASSINELLI G, FANTINI G, et al. Adriamycin, 14-hydroxydaunomycin, a new antitumor antibiotic from S. peucetius var. caesius[J]. Biotechnol Bioeng, 1969, 11(6):1101-1110.[4] MINOTTI G, MENNA P, SALVATORELLI E, et al. Anthracyclines: molecular advances and pharmacologic developments in antitumor activity and cardiotoxicity[J]. Pharmacol Rev, 2004, 56(2):185-229.[5] MALPAS J S. Chemotherapy in the management of ovarian carcinoma: a review[J]. J R Soc Med, 1979, 72(5):357-361.[6] GABIZON A, MARTIN F. Polyethylene glycol-coated (pegylated) liposomal doxorubicin. Rationale for use in solid tumours[J]. Drugs, 1997, 54 Suppl 4:15-21.[7] GABIZON A, CATANE R, UZIELY B, et al. Prolonged circulation time and enhanced accumulation in malignant exudates of doxorubicin encapsulated in polyethylene-glycol coated liposomes[J]. Cancer Res, 1994, 54(4):987-992.[8] 多美素®(盐酸多柔比星脂质体注射液)[Z].石家庄:石药整体 中奇制药手艺 (石家庄)有限公司,2018.[9] HASHIZUME H, BALUK P, MORIKAWA S, et al. Openings between defective endothelial cells explain tumor vessel leakiness[J]. Am J Pathol, 2000, 156(4):1363-1380.[10] MAEDA H, TSUKIGAWA K, FANG J. A Retrospective 30 Years After Discovery of the Enhanced Permeability and Retention Effect of Solid Tumors: Next-Generation Chemotherapeutics and Photodynamic Therapy--Problems, Solutions, and Prospects[J]. Microcirculation, 2016, 23(3):173-182.[11] VON MOOS R, THUERLIMANN B J, AAPRO M, et al. Pegylated liposomal doxorubicin-associated hand-foot syndrome: recommendations of an international panel of experts[J]. Eur J Cancer, 2008, 44(6):781-790.[12] CHARROIS G J, ALLEN T M. Rate of biodistribution of STEALTH liposomes to tumor and skin: influence of liposome diameter and implications for toxicity and therapeutic activity[J]. Biochim Biophys Acta, 2003, 1609(1):102-108.[13] SWAIN S M, WHALEY F S, EWER M S. Congestive heart failure in patients treated with doxorubicin: a retrospective analysis of three trials[J]. Cancer, 2003, 97(11):2869-2879.[14] ZAMORANO J L, LANCELLOTTI P, MUÑOZ D R, et al. 2016ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC)[J]. Eur Heart J, 2016, 37(36):2768-2801.[15] CURIGLIANO G, CARDINALE D, SUTER T, et al. Cardiovascular toxicity induced by chemotherapy, targeted agents and radiotherapy: ESMO Clinical Practice Guidelines[J]. Ann Oncol, 2012, 23 Suppl 7:vii155-166.[16] ANDREOPOULOU E, GAIOTTI D, KIM E, et al. Pegylated liposomal doxorubicin HCL (PLD; Caelyx/Doxil): experience with long-term maintenance in responding patients with recurrent epithelial ovarian cancer[J]. Ann Oncol, 2007, 18(4):716-721.[17] PIGNATA S, SCAMBIA G, FERRANDINA G, et al. Carboplatin plus paclitaxel versus carboplatin plus pegylated liposomal doxorubicin as first-line treatment for patients with ovarian cancer: the MITO-2 randomized phase Ⅲ trial[J]. J Clin Oncol, 2011, 29(27):3628-3635.[18] PUJADE-LAURAINE E, WAGNER U, AAVALL-LUNDQVIST E, et al.Pegylated liposomal Doxorubicin and Carboplatin compared with Paclitaxel and Carboplatin for patients with platinum-sensitive ovarian cancer in late relapse[J]. J Clin Oncol, 2010, 28(20):3323-3329.[19] WAGNER U, MARTH C, LARGILLIER R, et al. Final overall survival results of phase Ⅲ GCIG CALYPSO trial of pegylated liposomal doxorubicin and carboplatin vs paclitaxel and carboplatin in platinum-sensitive ovarian cancer patients[J]. Br J Cancer, 2012, 107(4):588-591.[20] BRUNDAGE M, GROPP M, MEFTI F, et al. Health-related quality of life in recurrent platinum-sensitive ovarian cancer--results from the CALYPSO trial[J]. Ann Oncol, 2012, 23(8): 2020-2027.[21] GLADIEFF L, FERRERO A, RAUGLAUDRE G D, et al. Carboplatin and pegylated liposomal doxorubicin versus carboplatin and paclitaxel in partially platinum-sensitive ovarian cancer patients: results from a subset analysis of the CALYPSO phase Ⅲ trial[J]. Ann Oncol, 2012, 23(5):1185-1189.[22] PFISTERER J, SHANNON C M, BAUMANN K, et al. Bevacizumab and platinum-based combinations for recurrent ovarian cancer: a randomised, open-label, phase 3 trial[J]. Lancet Oncol, 2020, 21(5):699-709.[23] GORDON A N, FLEAGLE J T, GUTHRIE D, et al. Recurrent epithelial ovarian carcinoma: a randomized phase Ⅲ study of pegylated liposomal doxorubicin versus topotecan[J]. J Clin Oncol, 2001, 19(14):3312-3322.[24] MUTCH D G, ORLANDO M, GOSS T, et al. Randomized phase Ⅲ trial of gemcitabine compared with pegylated liposomaldoxorubicin in patients with platinum-resistant ovarian cancer[J]. J Clin Oncol, 2007, 25(19):2811-2818.[25] PUJADE-LAURAINE E, HILPERT F, WEBER B, et al. Bevacizumab combined with chemotherapy for platinum-resistant recurrent ovarian cancer: the AURELIA open-label randomized phase Ⅲ trial[J]. J Clin Oncol, 2014, 32(13):1302-1308.[26] POVEDA A M, SELLE F, HILPERT F, et al. Bevacizumab Combined With Weekly Paclitaxel, Pegylated Liposomal Doxorubicin, or Topotecan in Platinum-Resistant Recurrent Ovarian Cancer: Analysis by Chemotherapy Cohort of the Randomized Phase Ⅲ AURELIA Trial[J]. J Clin Oncol, 2015, 33(32):3836-3838.[27] 曹冬焱.脂质体阿霉素(多美素®)治疗卵巢癌的中国数据[R].珠海:中华医学会第十四次天下 妇产科学学术聚会会议,2019.[28] COLEMAN R L, GORDON A, BARTER J, et al. Early changes in CA125 after treatment with pegylated liposomal doxorubicin or topotecan do not always reflect best response in recurrent ovarian cancer patients[J]. Oncologist, 2007, 12(1):72-78.[29] SABBATINI P, MOONEY D, IASONOS A, et al. Early CA-125 fluctuations in patients with recurrent ovarian cancer receiving chemotherapy[J]. Int J Gynecol Cancer, 2007, 17(3):589-594.[30] GOSSNER G, COLEMAN R L, MUTCH D G, et al. CA-125 response in patients with recurrent ovarian or primary peritoneal cancer treated with pegylated liposomal doxorubicin or topotecan[J]. Gynecol Oncol, 2006, 103(1):212-218.[31] TANGUAY J S, ANSARI J, BUCKLEY L, et al. Epithelial ovarian cancer: role of pegylated liposomal Doxorubicin in prolonging the platinum-free interval and cancer antigen 125 trends during treatment[J]. Int J Gynecol Cancer, 2009, 19(3):361-366.[32] MUGGIA F M, BLESSING J A, SOROSKY J, et al. Phase Ⅱ trial of the pegylated liposomal doxorubicin in previously treated metastatic endometrial cancer: a Gynecologic Oncology Group study[J]. J Clin Oncol, 2002, 20(9):2360-2364.[33] PIGNATA S, SCAMBIA G, PISANO C, et al. A multicentre phase Ⅱ study of carboplatin plus pegylated liposomal doxoru-bicin as first-line chemotherapy for patients with advanced or recurrent endometrial carcinoma: the END-1 study of the MITO (Multicentre Italian Trials in Ovarian Cancer and Gynecologic Malignancies) group[J]. Br J Cancer, 2007, 96(11):1639-1643.[34] DU BOIS A, PFISTERER J, BURCHARDI N, et al. Combination therapy with pegylated liposomal doxorubicin and carboplatin in gynecologic malignancies: a prospective phase Ⅱ study of the Arbeitsgemeinschaft Gynaekologische Onkologie Studiengruppe Ovarialkarzinom (AGO-OVAR) and Kommission Uterus (AGO-K-Ut)[J]. Gynecol Oncol, 2007, 107(3):518-525.[35] SUTTON G, BLESSING J, HANJANI P, et al. Phase Ⅱ evaluation of liposomal doxorubicin (Doxil) in recurrent or advanced leiomyosarcoma of the uterus: a Gynecologic Oncology Group study[J]. Gynecol Oncol, 2005, 96(3):749-752.[36] HARTER P, SEHOULI J, REUSS A, et al. Phase Ⅱ Study Eval-uating PegLiposomal Doxorubicin and Carboplatin Combination Chemotherapy in Gynecologic Sarcomas and Mixed Epithelial-Mesenchymal Tumors A PhaseⅡ Protocol of the Arbeitsgemeinschaft Gynaekologische Onkologie Study Group (AGO-GYN 7)[J]. Int J Gynecol Cancer, 2016, 26(9):1636-1641.[37] ROSE P G, BLESSING J A, LELE S, et al. Evaluation of pegylated liposomal doxorubicin (Doxil) as second-line chemotherapy of squamous cell carcinoma of the cervix: a phase Ⅱ study of the Gynecologic Oncology Group[J]. GynecolOncol, 2006, 102(2):210-213.[38] VERSCHRAEGEN C F, KAVANAGH J J, LOYER E, et al. Phase Ⅱ study of carboplatin and liposomal doxorubicin in patients with recurrent squamous cell carcinoma of the cervix[J]. Cancer, 2001, 92(9):2327-2333.[39] CAELYX®(Pegylated Liposomal Doxorubicin Hydrochloride for Injection) [Z]. Toronto: Janssen Inc, 2018.[40] VON GRUENIGEN V, FRASURE H, FUSCO N, et al. A double-blind, randomized trial of pyridoxine versus placebo for the prevention of pegylated liposomal doxorubicin-related hand-foot syndrome in gynecologic oncology patients[J]. Cancer, 2010, 116(20):4735-4743.[41] BUN S, YUNOKAWA M, TAMAKI Y, et al. Symptom management: the utility of regional cooling for hand-foot syndrome induced by pegylated liposomal doxorubicin in ovarian cancer[J]. Support Care Cancer, 2018, 26(7):2161-2166.[42] TEMPLETON A J, RIBI K, SURBER C, et al. Prevention of palmar-plantar erythrodysesthesia with an antiperspirant in breast cancer patients treated with pegylated liposomal doxorubicin (SAKK 92/08)[J]. Breast, 2014, 23(3):244-249.[43] HONG C H L, GUEIROS L A, FULTON J S, et al. Systematic review of basic oral care for the management of oral mucositis in cancer patients and clinical practice guidelines[J]. Support Care Cancer, 2019, 27(10):3949-3967.[44] RILEY P, GLENNY A M, WORTHINGTON H V, et al. Interventions for preventing oral mucositis in patients with cancer receiving treatment: oral cryotherapy[J]. Cochrane Database Syst Rev, 2015(12):CD011552.[45] RILEY P, GLENNY A M, WORTHINGTON H V, et al. Interventions for preventing oral mucositis in patients with cancer receiving treatment: cytokines and growth factors[J]. Cochrane Database Syst Rev, 2018, 11(11):CD011990.[46] LALLA R V, BOWEN J, BARASCH A, et al. MASCC/ISOO clinical practice guidelines for the management of mucositis secondary to cancer therapy[J]. Cancer, 2014, 120(10):1453-1461.[47] HE M. Interventions for preventing oral mucositis in patients with cancer receiving treatment[J]. Clin Nurse Spec, 2011, 25(6):284-285.[48] YAROM N, HOVAN A, BOSSI P, et al. Systematic review of natural and miscellaneous agents for the management of oral mucositis in cancer patients and clinical practice guidelines-part 1: vitamins, minerals, and nutritional supplements[J]. Support Care Cancer, 2019, 27(10):3997-4010.[49] MCGUIRE D B, FULTON J S, PARK J, et al. Systematic review of basic oral care for the management of oral mucositis in cancer patients[J]. Support Care Cancer, 2013, 21(11):3165-3177.推荐阅读:
新书推荐|《中国妇科恶性肿瘤临床实践指南》(第6版)刚刚,妇科恶性肿瘤紫杉类药物临床应用专家共识重磅宣布国际权威肿瘤中央 不推荐早期宫颈癌接纳微创手术?我国专家有话说《妇科肿瘤抗血管内皮生长因子单克隆抗体临床应用指南》全文揭晓 天下 卵巢癌日|卵巢癌PARP抑制剂临床应用指南重磅宣布女性朋侪 看过来!妇科肿瘤专家针对HPV疫苗配合启动了一件大事